Структурно-функциональные исследования белков экстремофильных микроорганизмов
Проект выполняется в рамках гранта Российского Научного Фонда № 14-24-00172
В процессе эволюции микроорганизмы колонизовали самые неблагоприятные с точки зрения человека, экстремальные среды обитания. Представителей микробных сообществ можно встретить глубоко под землей на глубине до 6.7 км, на дне океанов где давление достигает 110 МРа, в условиях экстремальной кислотности (рН 0) и основности (рН 12.8) среды, в гидротермальных источниках при 122˚С и замерзшей морской воде при температуре – 22˚С.
Адаптация микроорганизмов к экстремальным условиям обитания может реализовываться на различных иерархических уровнях — на уровне микробного сообщества, на уровне клеточных процессов и на молекулярном, биохимическом уровне. Адаптационные механизмы экстремофилов включают целый ряд процессов, в том числе изменение липидного состава мембран по сравнению с нейтрофильными организмами, синтез органических осморегуляторов в ответ на осмотический шок, а также изменение состава и свойств белков — ключевых компонентов метаболических путей, обеспечивающих более эффективное превращение субстратов – источников биомассы и энергии. Последний тип адаптации представляет особый интерес, поскольку делает экстремофилы перспективным источником белков и ферментов с уникальными свойствами, структурно-функциональное исследование которых позволит создать теоретическую базу для конструирования генноинженерных белков, обладающих высокой активностью и стабильностью в экстремальных условиях (рН, соленость, температура и т.д.).
Информация о структурных особенностях белков экстремофильных микроорганизмов все еще достаточно ограничена и в основном связана с белками из термофилов. Весьма актуальным является расширение базы знаний о принципах структурной организации белков экстремофилов из других ниш обитания (галофилов, алкалифилов и т.п.), тем более, что многие белки способны проявлять т.н. полиэкстремофильные свойства, например, устойчивость одновременно к высоким температурам, концентрациям солей и экстремальным значениям рН. Структурные основы подобных уникальных свойств требуют дополнительного изучения.
В результате выполнения проекта будет проведена структурно-функциональная характеристика белков экстремофильных микроорганизмов, адаптированных к различным условиям обитания – высокой/низкой температуре, рН среды, концентрации солей. Сравнение пространственных структур белков, выполняющих одни и те же функции, но выделенных из организмов, приспособленных для жизни в различных условиях, позволит выявить общие закономерности структурной адаптации белков к экстремальным условиям.
Основными составляющими элементами проекта являются:
- экстремофильные микроорганизмы как источник разнообразия белков и ферментов с уникальными свойствами;
- белки и ферменты – непосредственные объекты исследования;
- структурно-функциональная характеристика отобранных для исследования белков экстремофильных микроорганизмов.
- сравнительный анализ функциональных свойств и структуры ферментов из экстремофильных организмов с гомологичными ферментами из мезофилов.
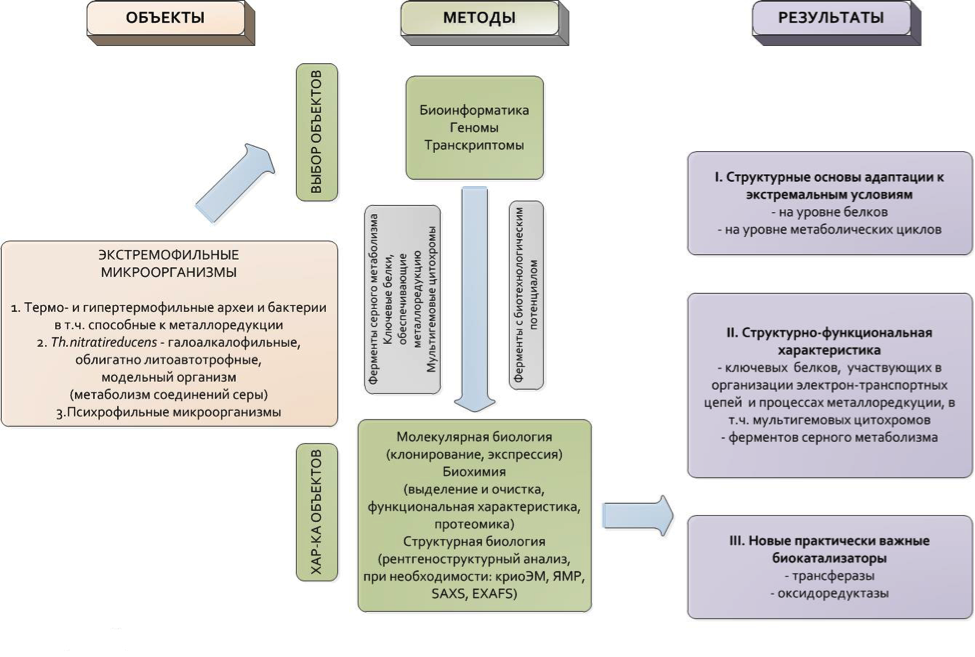 Общая схема реализации проекта
Общая схема реализации проекта
В качестве источников белковых объектов для структурно-функциональных исследований выступают следующие экстремофильные микроорганизмы и/или их геномы:
- бактерии рода Thioalkalivibrio
- термо- и гипертермофильные археи
- экстремофилы, для которых показана способность к металлоредукции
- психрофильные микроорганизмы.
Коллектив исполнителей в течение последних лет успешно сотрудничает в области структурно-функциональных исследований с ИНМИ РАН и Центром Биоинженерии РАН, в котором проводилось полногеномное секвенирование данных микроорганизмов. С 2015 года организация-исполнитель проекта, ИНМИ РАН и Центр Биоинженерии РАН объединились в ФИЦ Биотехнологии РАН, что поспособствовало более тесной интеграции компетенций, в том числе в рамках проекта.
Коллектив исполнителей обладает всеми необходимыми компетенциями для успешной реализации проекта, соответствующей материально-технической базой и имеет партнерские отношения с рядом ведущих международных центров, работающих в области структурной биологии (EMBL, ESRF, Spring8).
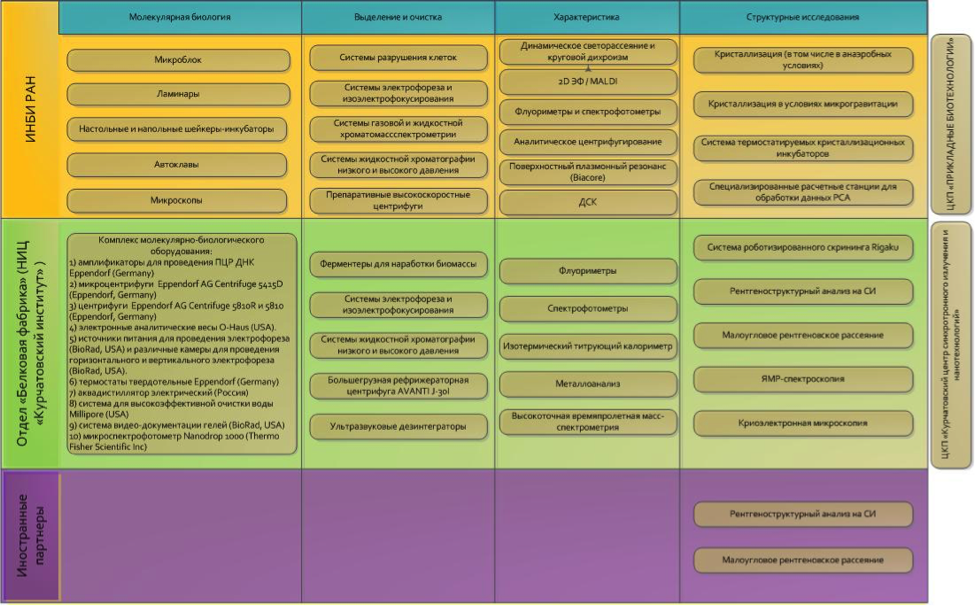 Перечень и схема распределения научного оборудования, имеющегося в распоряжении коллектива исполнителей
Перечень и схема распределения научного оборудования, имеющегося в распоряжении коллектива исполнителей
Публикации в рамках проекта за 2014 год:
1. Evgeny Osipov, Konstantin Polyakov, Roman Kittl, Sergey Shleev, Pavel Dorovatovsky, Tamara Tikhonova, Stephan Hann, Roland Ludwig and Vladimir Popov Effect of the L499M mutation of the ascomycetous Botrytis aclada laccase on redox potential and catalytic properties Acta Crystallographica Section D Biological Crystallography (2014)
2. Konstantin Boyko, Marina Gorbacheva, Tatiana Rakitina, Dmitry Korzhenevskiy, Anna Vanyushkina, Dmitry Kamashev, Alexey Lipkin and Vladimir Popov Expression, purification, crystallization and preliminary X-ray crystallographic analysis of histone-like HU-protein from Spiroplasma melliferum KC3 Acta Crystallographica Section F (2015)
3. Tatyana N. Safonova, Sergey N. Mikhailov, Vladimir P. Veiko, Nadezhda N. Mordkovich, Valentin A. Manuvera, Cyril S. Alekseev, Mikhail V. Kovalchuk, Vladimir O. Popov and Konstantin M. Polyakov High-syn conformation of uridine and asymmetry of the hexameric molecule revealed in the high-resolution structures of Shewanella oneidensis MR-1 uridine phosphorylase in the free form and in complex with uridine Acta Crystallographica Section D: Biological Crystallography (2014)
Публикации в рамках проекта за 2015 год:
1. Ekaterina Yu. Bezsudnova, Tatiana E. Petrova, Anna V. Popinako, Mikhail Yu. Antonov, Tatiana N. Stekhanova and Vladimir O. Popov Intramolecular hydrogen bonding in the polyextremophilic short-chain dehydrogenase from the archaeon Thermococcus sibiricus and its close structural homologs Biochimie (2015 г.)
2. Modarres, Hassan; Dal Peraro, Matteo; Ravin, Nikolai; Dorokhov, Boris; Popov, Vladimir; Skryabin, Konstantin Understanding and Engineering Thermostability in the DNA Ligase from Thermococcus sp. 1519 BIOCHEMISTRY (2015 г)
3. Osipov E., Polyakov K., Tikhonova T., Kittl R., Dorovatovsky P., Shleev S., Popov V., Ludwig R., Incorporation of the copper ion into crystals of T2-depleted laccase from Botrytis aclada Acta crystallographica. Section F, Structural biology communications (2015 г.)
4. Slutskaya E., Artemova N., Kleymenov S., Petrova T., Popov V. Heat-induced conformational changes of TET peptidase from crenarchaeon Desulfurococcus kamchatkensis. EUROPEAN BIOPHYSICS JOURNAL WITH BIOPHYSICS LETTERS (2015 г.)
5. Tatiana Petrova, Ella Slutskaya, Konstantin Boyko, Olga Sokolova, Tatiana Rakitina, Dmitry Korzhenevskiy, Marina Gorbacheva, Ekaterina Bezsudnova and Vladimir Popov The localization of Trp residues on the surface of the dodecamer of the aminopeptidase APDkam598 from the archaeon Desulfurococcus kamchatkensis Acta Cryst.Sect.F (2015 г.)
6. Timofeev, V.I., Slutskaya, E.A., Korzhenevskiy, D.A., Gorbacheva, M.A., Boyko, K.M., Rakitina, T.V., Lipkin, A.V., Popov, V.O Crystal structure of recombinant prolidase from Thermococcus sibiricus at P21221 spacegroup. Acta Cryst (2015 г.)
7. Trofimov A.A., Polyakov K.M., Lazarenko V.A., Popov A.N., Tikhonova T.V., Tikhonov А.V., Popov V.O. Structural study of the X-ray induced enzymatic reaction of octaheme cytochrome c nitrite reductase. Acta Cryst D (2015 г.)
8. К.М. Бойко, В.О. Попов, М.В. Ковальчук Перспективные методы кристаллизации макромолекул, уменьшающие конвекционный транспорт вещества к растущему кристаллу Успехи Химии (2015 г.)
9. Михайлова А.Г., Некрасов А.Н., Зинченко А.А., Ракитина Т.В., Корженевский Д.А., Липкин А.В., Разгуляева О.А., Овчинникова М.В., Горленко В.А., Румш Л.Д. Укороченные варианты олигопептидазы В из Serratia proteamaculas с измененной активностью Биохимия (2015 г.)
10. Safonova T.N., Mordkovich N.N., Veiko V.P., Okorokova N.A., Manuvera V.A., Dorovatovsky P.V., Popov V.O., Polyakov K.M. Concerted action of two subunits of the functional dimer of Shewanella oneidesis MR-1 uridine phosphorylase derived from a comparison of the C212S mutant and the wild-type enzyme. Acta crystallogr.Sect.D, (ожидается рецензия).
11. Boyko Konstantin, Stekhanova Tatiana, Nikolaeva Alena, Mardanov Andrey V., Rakitin Andrey L., Ravin Nikolai V., Bezsudnova Ekaterina and Popov Vladimir “First structure of archaeal branched-chain transaminase from Thermoproteus uzoniensis with specificity to L-amino acids and R-amines”, Extremophiles. (Положительная рецензия получена, исправленная статья отослана в редакцию).
План работы на 2016 год:
1. Характеристика строения и свойств активного центра тиоцианатдегидрогеназы из галоалкалофильной бактерии Tv. paradoxus спектральными методами ЭПР, EXAFS.
2. Продолжение работы по рентгеноструктурному анализу тиоцианатдегидрогеназы из бактерии Tv. paradoxus: получение структуры комплексов TCDH с субстратом – тиоцианатом и ингибиторами (цианатом и цианидом).
3. Получение, структурная и функциональная характеристика точечных мутантов тиоцианатдегидрогеназы с целью установления механизма действия фермента.
4. Выделение и характеристика ферментов серуокисляющей системы Sox из галоалкалофильных бактерий Tv. nitratireducens и Tv. paradoxus. Кристаллизация с целью последующего определения структуры методом рентгеноструктурного анализа.
5. Оптимизация системы экспрессии генов мультигемовых цитохромов с в клетках E. coli. Получение и функциональная характеристика генно-инженерных форм мультигемовых цитохромов с — потенциальных участников процесса экстраклеточного транспорта электронов у термофильных металлоредукторов.
6. Характеристика ω-аминотрансфераз из бактерии Psychrobacter cryohalolentis и археи Vulcanisaeta moutnovskia: исследование субстратной специфичности и физико-химических свойств ферментов. Учитывая низкую растворимость аминотрансферазы из V. moutnovskia будет проведен дополнительный поиск гомологичной ω-аминотрансферазы в геномах гипертермофильных архей. Будут проведены выделение и характеристика рекомбинантной формы нового фермента.
7. Характеристика R-селективных трансаминаз из экстремофильных организмов Мethanococcus vannielii SB, Thermomicrobium roseum, Haliangium ochraceum и Thermobaculum terrenum ATCC. Анализ R-специфичности в реакциях с различными алифатическими и ароматическими субстратами. Рациональный дизайн отобранной трансаминазы с использованием данных по структуре и результатов моделирования с целью повышения активности в реакциях с R-хиральными аминами при сохранении термостабильности ферментов.
8. Кристаллизация ω-аминотрансферазы из Psychrobacter cryohalolentis и гомологичных аминотрансфераз из архей, продолжение кристаллизации R-селективных трансаминаз из археи Thermomicrobium roseum и бактерий Thermobaculum terrenum ATCC и Haliangium ochraceum. По мере получения качественных кристаллов проведение рентгеноструктурного эксперимента, обработка полученных данных, решение и уточнение новых структур, анализ полученных структур, депонирование координат в банк данных PDB.
9. Уточнение решенных структур холо-формы и комплексов R-селективной трансаминазы из археи M.vannielii и комплекса трансаминазы с L-norVal из археи Thermoproteus uzoniensis, депонирование координат в банк данных PDB.
10. Анализ строения активного центра и структурной организации белковой глобулы исследуемых трансаминаз. Исследование структурных факторов, повышающих стабильность и активность ферментов в экстремальных условиях.
11. Сравнительный анализ структур термостабильных R-селективных трансаминаз из архей со структурами R-селективных трансаминаз из мезофильных организмов Aspergillius terreus и Nectria haematococca. Сравнительный анализ структур термостабильной трансаминазы IV класса из Thermoproteus uzoniensis со структурами гомологичных ферментов из мезофильных организмов. Выявление структурных факторов термостабильности у трансаминаз.