Исследователи из ФИЦ Биотехнологии РАН в составе международной группы изучили ферменты микроорганизмов, способные эффективно разлагать растительные полисахариды даже в кипящей воде. Оптимальная температура работы этих белков составляет 90 и 100 °C. Это уникальный уровень устойчивости белков к высоким температурам, который позволяет их продуцентам, гипертермофильным археям, выживать в горячих источниках с суровыми или резко меняющимися условиями. Статья, посвященная этому исследованию, вышла на страницах The FEBS Journal.
Бактерии и грибы могут легко разрушать стенки растительных клеток благодаря различным ферментам — особым белкам, ускоряющим химические реакции. Однако науке пока мало известно о том, какую роль в разложении растительного материала играют археи — микроорганизмы без ядра, которые отличаются от бактерий по своему устройству и функционированию клетки. В связи с этим у архей можно обнаружить огромное разнообразие новых ферментов, среди которых могут оказаться и перспективные молекулы для биотехнологий. Одним из самых полезных свойств этих белков считается возможность работать при высоких температурах, благодаря чему такие молекулы можно использовать, чтобы ускорять реакции в лаборатории или промышленности. Исследователи ФИЦ Биотехнологии РАН вместе с коллегами из разных стран изучили структуру таких ферментов с оптимальной температурой работы около 100 °C.
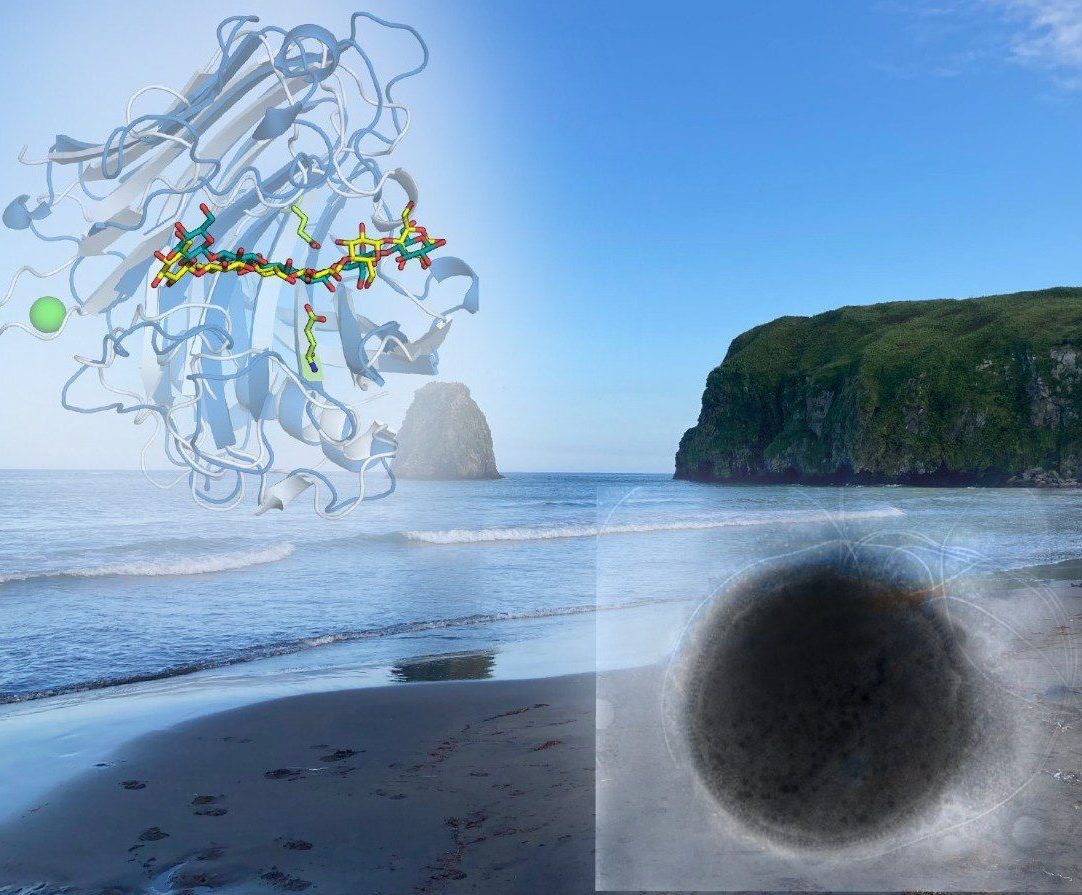 «Не так давно мы открыли новый фермент — мультидоменную гликозидазу. Он состоит из трех каталитических доменов — одного GH5 и двух GH12, а также двух модулей для связывания целлюлозы — полисахарида, который составляет основу клеточной стенки растений. Ранее нами была показана способность этого мультидоменного белка, который был получен рекомбинантно, разлагать обширный список полисахаридов при 60 °С. То же самое удалось выяснить и для GH5 домена, который успешно работал как самостоятельный фермент. Однако роль остальных каталитических доменов была неясна, поэтому в новом исследовании мы изучили работу доменов GH12», — пояснила соавтор работы Ксения Заюлина, кандидат биологических наук, научный сотрудник лаборатории метаболизма экстремофильных прокариот ФИЦ Биотехнологии РАН.
«Не так давно мы открыли новый фермент — мультидоменную гликозидазу. Он состоит из трех каталитических доменов — одного GH5 и двух GH12, а также двух модулей для связывания целлюлозы — полисахарида, который составляет основу клеточной стенки растений. Ранее нами была показана способность этого мультидоменного белка, который был получен рекомбинантно, разлагать обширный список полисахаридов при 60 °С. То же самое удалось выяснить и для GH5 домена, который успешно работал как самостоятельный фермент. Однако роль остальных каталитических доменов была неясна, поэтому в новом исследовании мы изучили работу доменов GH12», — пояснила соавтор работы Ксения Заюлина, кандидат биологических наук, научный сотрудник лаборатории метаболизма экстремофильных прокариот ФИЦ Биотехнологии РАН.
Мультидоменная гликозидаза (МДГ) гипертермофильной археи из рода Thermococcus относится к классу ферментов, которые разрушают химические связи в молекулах полисахаридов, в частности, целлюлозы, что позволяет этому микроорганизму разлагать растительные остатки и использовать их как источник углерода. Действие МДГ до сих пор было изучено лишь частично: в отличие от домена GH5, домены семейства GH12, которых в структуре фермента два, не были получены рекомбинантно и охарактеризованы, а их роль для цельного фермента оставалось непонятной. Авторы работы решили заполнить этот пробел.
Исследователи выяснили, что GH5 и оба домена GH12 отличаются не только субстратной специфичности, так и по оптимальным значениям температуры и рН для своей работы. Все три домена имеют разную эволюционную историю — несмотря на то, что кодируются они одним и тем же геном.
Первый домен TMDG_GH12-1, оптимально работающий в кислой среде (рН 5) при температуре 100 °C (и функционирующий в диапазоне 40–130 °C), оказался одним из самых термостабильных среди всех известных гликозидаз и целлюлаз, в частности. Белок терял половину активности спустя 42 часа при 100 °C, а при 90 °C сохранял полную активность в течение 11 суток. Ученые нашли предполагаемые причины такой уникальной термостабильности: небольшую мутацию – замену аминокислоты триптофана на глутамин, а также больше дисульфидных мостиков в структуре белковой молекулы.
Второй домен, TMDG_GH12-2, гораздо лучше работал при высоких значениях pH (то есть, в щелочной среде). При этом оптимальная температура для него составила 90 °C (диапазон работы от 50 до 100 °C), а при 100 °C этот фермент терял половину активности через 30 минут. Для этого белка была получена кристаллическая структура, и благодаря сайт-направленному мутагенезу, определены ключевые аминокислоты, влияющие на работу и стабильность фермента.
«Благодаря трем видам доменов с различающимися характеристиками, мультидоменная гликозидаза данной гипертермофильной археи из рода Thermococcus может работать при разных условиях, позволяя этим микроорганизмам адаптироваться к изменениям окружающей среды. Благодаря этому, этой архее удается выживать в экологической нише с часто меняющимися условиями —зоне приливов и отливов, где температура, соленость, pH и количество доступного питательного вещества могут сильно колебаться даже в течение суток», — добавила Ксения Заюлина.
В дальнейшем ученые планируют продолжить работу и выделить фермент с версией TMDG_GH12-1 в чистом кристаллическом виде, чтобы лучше понять причины его термостабильности.