AstaP – группа каротиноид-связывающих белков, обнаруженных в микроводорослях. «Ядро» белка AstaP составляет домен FAS1, широко распространенный в различных организмах — от бактерий до человека. Ранее этот домен был описан только для белков клеточной адгезии. AstaPo1 – первый белок, для которого была обнаружена новая функция, которую может выполнять FAS1 домен: связывание каротиноидов. Сотрудники группы «Белок-белковые взаимодействия» ФИЦ Биотехнологии РАН и лаборатории биомолекулярной ЯМР-спектроскопии ИБХ РАН исследовали пространственную структуру AstaPo1 и её связь с функцией белка. Результаты работы опубликованы в журнале Communications biology.
Каротиноиды – мощные антиоксиданты, помогающие клеткам бороться с окислительным стрессом. Высокое содержание каротиноидов в диете человека коррелирует с уменьшением риска нейродегенеративных расстройств, различных видов рака, сердечно-сосудистых и офтальмологических заболеваний. Так как окислительный стресс либо является причиной, либо сопровождает данные заболевания, то если использовать каротиноиды в качестве антиоксидантов, возможно предупредить, затормозить или остановить их развитие. Однако, крайне низкая растворимость (за счет высокой гидрофобности) молекул каротиноидов является одним из препятствий для их применения в терапевтических целях. В качестве решения этой проблемы могут подойти природные солюбилизаторы – каротиноид-связывающие белки.
AstaP – группа каротиноид-связывающих белков, обнаруженных в микроводорослях. «Ядро» белка AstaP составляет домен FAS1, широко распространенный в различных организмах, от бактерий до человека. Ранее этот домен был описан только для белков клеточной адгезии. AstaPo1 – первый белок, для которого была обнаружена новая функция, которую может выполнять FAS1 домен: связывание каротиноидов. Кроме того, в отличие от других известных каротиноид-связывающих белков AstaPo1 гораздо более универсален: он может образовывать комплекс с различными соединениями – астаксантином, кантаксантином, лютеином, зеаксантином и β-каротином.
Структура комплекса AstaPo1 с молекулой астаксантина была определена при помощи ЯМР-спектроскопии, метод ранее никогда не использовался для изучения белков в комплексах с каротиноидами.
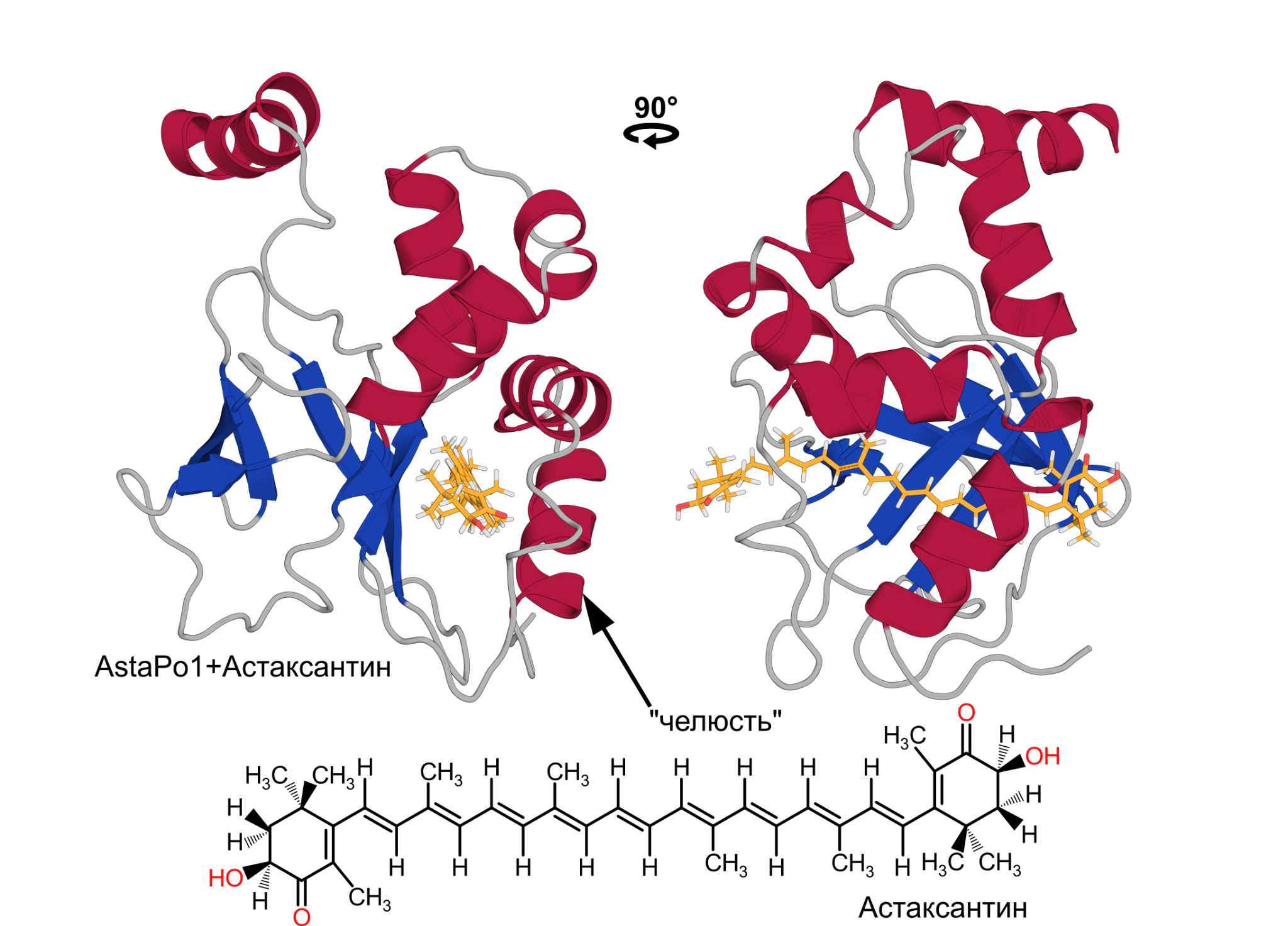 Трехмерная структура комплекса AstaPo1 с молекулой каротиноида астаксантина
Трехмерная структура комплекса AstaPo1 с молекулой каротиноида астаксантина
Оказалось, что AstaPo1 связывает астаксантин в гидрофобном туннеле, при этом длины туннеля не хватает, чтобы поместить туда всю молекулу. В результате, концевые «кольца» астаксантина находятся в водном окружении, а в “пасть” белка попадает только его “жирная” цепочка. Таким образом, взаимодействие между лигандом и AstaPo1 получается неспецифическим. Это объясняет широкий набор каротиноидов, которые связывает AstaPo1.
Трехмерная структура AstaPo1 была использована для поиска характеристик, которые позволяют доменам FAS1 связывать молекулы каротиноидов. C этой целью был проведен биоинформатический анализ, сделаны точечные мутации и измерена активность разных вариантов белка. Оказалось, что замены аминокислот в гидрофобном туннеле не мешают связыванию каротиноидов, поэтому, вероятно, секрет этой функции доменов FAS1 скрыт не в свойствах туннеля, а в том, каким образом происходит захват молекул из мембран клеток. Для анализа механизмов захвата были сделаны укороченные версии белка, в которых удаляли неупорядоченные фрагменты, которые, как выяснилось, также не влияют на образование комплекса белка с каротиноидами. С одной стороны, это позволило значительно уменьшить минимальный размер активного белка, с другой, причины, по которым белки схожей структуры не в состоянии связывать и переносить каротиноиды, в то время как AstaPo1 может это делать, так и остались загадкой.
Тем не менее, в результате анализа трехмерной структуры и подвижности белка без астаксантина и в комплексе с ним, удалось предложить механизм, по которому AstaPo1 может связывать каротиноиды из мембраны клеток. В процессе предположительно участвует область молекулы, которая была названа «челюстью». Эта «челюсть”, состоящая из двух спиральных участков, может отсоединяться от остальной молекулы белка и, по-видимому, в состоянии погрузиться в мембрану и связать длинную цепочку каротиноида.
Работа поддержана при поддержке национального проекта «Наука и университеты» (субсидия Министерства Образования и Науки № 075-15-2021-1354), а также грантом Президента РФ № МД 2834.2022.1.4.